Une biomolécule décryptée par laser à électrons libres
 Une équipe de chercheurs internationaux a analysé la structure interne d'une biomolécule à l'aide d'un laser à électrons libres.
Une équipe de chercheurs internationaux a analysé la structure interne d'une biomolécule à l'aide d'un laser à électrons libres.
La structure des biomolécules revêt une importance fondamentale en médecine et en biologie, car leur forme détermine souvent leur fonction. La structure d'une enzyme permet également, dans le meilleur des cas, de mettre au point des médicaments sur mesure. Jusqu'à présent, les molécules étaient analysées au moyen d'une méthode de cristallographie sur des sources de faisceaux synchrotron : une méthode qui nécessite des échantillons avec des cristaux comparativement grands et très réguliers. Or, de nombreuses biomolécules sont difficiles à cristalliser et résistent mal aux rayons.
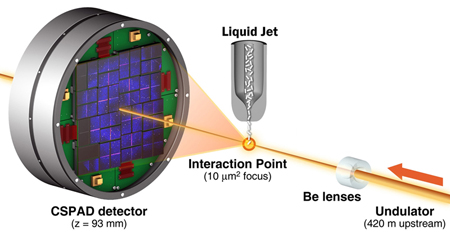
De nouveaux lasers X tels que la Linac Coherent Light Source (LCLS) du Centre américain d'accélérateurs SLAC à Menlo Park (Californie), ou encore le laser X à électrons libres européen European XFEL, actuellement en construction à Hambourg, offrent désormais la possibilité d'analyser des structures jusqu'alors inaccessibles. En effet, l'intensité des rayons de ces instruments est si puissante que même de minuscules cristaux suffisent pour donner des images exploitables. Bien que la forte lumière des rayons détruise presque instantanément les échantillons, il est possible de prendre d'excellentes photos avant l'évaporation de ceux-ci.
Une équipe internationale qui rassemble des chercheurs du Center for Free-Electron Laser Science (CFEL) du campus DESY, de l'université de Hambourg et du MPI de recherche médicale de Heidelberg, est parvenue à déterminer la structure de l'enzyme lysozyme présente dans l'ovalbumine avec une résolution spatiale de 0,19 nm. Pour cela, les microcristaux de l'échantillon ont été irradiés avec un laser femtoseconde à une longueur d'onde de 0,132 nm.
Le lysozyme est une biomolécule dont la structure est parfaitement identifiée. Il a ainsi servi de système modèle dans l'étude en question, afin de déterminer la précision de la méthode et de démontrer que le laser X à électrons libres peut être utilisé pour analyser les structures biologiques.







